国际上约 5%的成年人及 8%的婴幼儿存在不同程度的食物过敏,尤其是近些年环境日益恶化,其发生率持续上升,然而至今尚无真正意义上的抗食物过敏药物。临床上多用抗组胺药(如:氯雷他定等)用于缓解过敏症状,因此抗食物过敏药物的创制具有巨大的市场价值。
BTL-I 是一个来自深海真菌的丁烯酸内酯类化合物,采用体外活性考察发现BTL-I 能够显著抑制 RBL-2H3 细胞的脱颗粒,也可降低 RBL-2H3 细胞释放组胺;此外,BTL-I 也可显著抑制 BMMCs 的激活,因此具有明显的体外抗食物过敏活性。进一步两种不同种属动物(小鼠和大鼠)活性验证实验中,BTL-I 能够缓解 OVA 诱导的食物过敏动物的反应症状、降低腹泻率、引发过敏动物体温回升,减弱肠道炎症,证明 BTL-I具有明显的体内抗食物过敏活性。初步的机制研究表明,BTL-I 对 OVA 特异性 IgE、组胺及 mMCP-1 有着明显的抑制作用;能够降低过敏小鼠脾脏和肠系膜淋巴细胞中 B细胞及肥大细胞的数量;此外,BTL-I 能够减弱肥大细胞介导的小鼠被动皮肤过敏反应,影响肥大细胞表面 c-KIT 的表达。证明 BTL-I 发挥抗食物过敏活性的机制是与抑制性受体 FcγRIIB 发生相互作用,进而抑制肥大细胞的激活,缓解过敏反应。在初期安全性评价中,急性毒性结果表明:BTL-I 对昆明种小鼠的最大耐受量为7.5 g/kg。经长期毒性考察,BTL-I 在 7.5 g/kg 剂量下对 SD 大鼠连续给药 14 天,动物无死亡现象。初步确定 BTL-I 安全性良好。
为满足临床试验需求,我们在前期生产工艺研究中,初步验证了菌株发酵工艺的稳定性及可行性,目前固体发酵产量可达 10 g/kg,液体发酵物产量可达到 1 g/L。进一步的提取和分离工艺的确定保证了 BTL-I 的纯度为 99.9%。已完成 BTL-I 的体内吸收,代谢,分布和排泄过程研究,为药代动力学重要参数获得提供重要依据,采用血清药物化学和肝微粒体实验等手段方法明确了 BTL-I在体内的主要代谢产物和代谢途径,同时明确了 BTL-I 在体内主要以原形及其同分异构体或水解物的形式存在。为后续药代动力学及组织分布实验提供了明确的考察目标。通过对 BTL-I 的生产工艺开发、药效学评价、药代动力学研究及安全性评价等成药性相关研究可以明确,BTL-I 目前已具备生产工艺稳定,抗食物过敏活性显著,作用机制明确,代谢产物及途径明确和安全性良好的特点,具备极高的成药性。
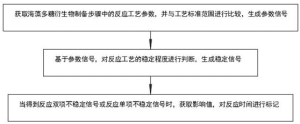
成果流程